Toepassingen van gentherapie met AAV
De auteursMarkttoelating is nodig om een nieuw medicijn te mogen voorschrijven aan patiënten. De eerste gentherapie op basis van AAV waarvoor dit werd verkregen was Glybera van UniQure in 2012. Deze behandeling was voor Lipoproteïne-lipase-deficiëntie, een erg zeldzame erfelijke stofwisselingsziekte die ongeveer 1 op de miljoen mensen treft.
Omdat er maar heel weinig patiënten zijn die voor een behandeling met deze therapie in aanmerking komen en de vraagprijs 1 miljoen euro was, is dit product niet verkocht en heeft de producent afgezien van verlenging van de handelsvergunning na 5 jaar. Toch is er een lichtpuntje. Deze markttoelating toonde aan dat het ontwikkelen van een gentherapieproduct, gevolgd door registratie, haalbaar is en heeft daarmee een impuls gegeven aan ontwikkeling van andere vergelijkbare producten. Inmiddels zijn er meerdere gentherapie behandelingen op basis van AAV-vectoren voor oogziekten en spierziekten toegelaten op de markt.
Is het effect van AAV- gentherapie blijvend?
De eerste in vivo gentherapie behandelingen met AAV-vectoren zijn meer dan 10 jaar geleden uitgevoerd. In de behandelde patiënten is er geen afname van het effect gezien en lijkt een blijvende genezing aannemelijk. Het effect van de behandeling wordt nog steeds gevolgd en dit zal op den duur duidelijk maken of een eenmalige gentherapie inderdaad een levenslange genezing geeft.
Toch zijn er twee manieren waarop het effect verloren kan gaan:
1. Afstoting van cellen die de AVV-vector bevatten
Het afweersysteem van de patiënt kan het functionele eiwit, dat na de gentherapie door het lichaam gemaakt wordt, zien als iets lichaamsvreemds. Dit kan tot afstoting leiden van de cellen die dit eiwit maken, waardoor het effect van de gentherapiebehandeling verloren gaat. Het lichaam ziet de virale verpakking zeker als iets lichaamsvreemds en het afweersysteem reageert daarop.
In de gentherapiestudies voor hemofilie is bijvoorbeeld leverontsteking opgetreden door reactie van het afweersysteem. Door deze patiënt met een kuur van ontstekingsremmers (corticosteroïden) te behandelen, kon de ontsteking worden onderdrukt en bleef het functionele eiwit behouden.
Bij gentherapie voor de behandeling van oogziekten is nog geen afstotingsreactie gezien, maar deze patiënten worden preventief behandeld met corticosteroïden. Deze ontsteking vormt een risico voor de patiënt. Tijdens medische onderzoeken wordt daarom nauwkeurig gekeken naar het optreden van leverontsteking door meting van bepaalde biomarkers in het bloed.
Voor andere organen of weefsels zoals de spieren, is de kans op een afweerreactie nog onbekend. Vanwege de afweerreactie tegen het omhulsel van de AAV-vector, die erg lijkt op een virus, is herhaalde toediening waarschijnlijk niet mogelijk. De gentherapiebedrijven werken wel aan technieken om herbehandeling mogelijk te maken.
2. Deling van de cellen die de AVV-vector bevatten
De AAV-vectoren integreren vrijwel niet in het genoom van de lichaamscel en verblijven apart als een minichromosoom aanwezig. Dit wordt episomaal genoemd. Hoewel AAV-vectoren vrijwel niet integreren in het genoom, komt het toch sporadisch voor en kunnen andere genen beschadigen of juist geactiveerd worden. De kans hierop neemt toe met de tijd dat de vector aanwezig is.
Bij celdeling wordt alleen het genoom gekopieerd zodat na deling beide dochtercellen een eigen kopie hebben. Bij celdeling worden de meeste AAV-vectoren uitverdund en daarmee waarschijnlijk ook het effect. Hier is niet veel over bekend. Dit betekent dat deze AAV-vectoren alleen geschikt zijn voor behandeling van weefsels die geen of weinig celdeling meer hebben zoals bijvoorbeeld het netvlies, de hersenen en de lever. Gentherapie op basis van AAV is dus niet geschikt voor snel delende cellen zoals de stamcellen uit het beenmerg.
Risico’s van AAV-gentherapie
Zoals bij iedere nieuwe therapie zijn er bekende en mogelijk ook onbekende risico’s..
- Tumorvorming
Activatie van een gen met een tumor-bevorderende functie, kan de kans op tumorvorming vergroten. Tot nu toe is dit in geen van de met AAV-vectoren behandelde patiënten gezien en ook uitgebreide dierstudies laten zien dat de kans hierop klein is. Langetermijnstudies in patiënten moeten duidelijk maken of de kans op deze ernstige bijwerking verwaarloosbaar is of een reëel risico.
- Nevenwerking
De AAV-vector is bedoeld voor een bepaald orgaan maar kan ook in andere weefsels terechtkomen en daar een effect hebben dat onbedoeld is.
- Overproductie
Deze gentherapie kan ook ertoe leiden dat er meer van het functionele eiwit wordt gemaakt dan bedoeld. Dit noemen we overproductie. Het hangt van het betreffende eiwit af of dit wel of niet gevaarlijk is.
- Voorzorgsmaatregelen
Verder zal in de eerste periode na de behandeling een klein gedeelte van de toegediende AAV-vector uitgescheiden worden. Bij toediening in een ader gaat het om speeksel, ontlasting, urine of sperma. Bij toediening in het oog, gaat het om traanvocht. Daar het om kleine hoeveelheden gaat van een niet ziekmakend virus, lijkt dit niet gevaarlijk voor partner, familie en vrienden. Uit voorzorg moeten mannen die behandeld zijn, gedurende de tijd dat viraal DNA wordt aangetoond in hun sperma, een condoom gebruiken. Dit kan wel tot een jaar duren dus dat heeft wel gevolgen voor eventuele kinderwens.
Gentherapie voor oogziekten
Voor de behandeling van erfelijke retinale dystrofie, een oogziekte veroorzaakt door mutaties in het RPE65-gen, is sinds november 2018 Luxturna (AAV2-RPE65) geregistreerd door het Europees Geneesmiddelenbureau EMA. Afwezigheid van dit RPE65-enzym leidt tot afsterven van de lichtgevoelige cellen in het netvlies. Het gezichtsvermogen gaat achteruit en de meeste patiënten zijn vrijwel blind voor hun 20ste levensjaar. Gentherapie met Luxturna (voretigene neparvovec) zorgt ervoor dat de cellen van het netvlies dit enzym weer kunnen aanmaken en het gezichtsvermogen niet verder achteruitgaat.
Een belangrijk voordeel van deze gentherapie is dat het netvlies met een injectienaald bereikt kan worden, en de AVV-vector heel lokaal en gericht wordt toegediend. Bovendien is er maar een kleine hoeveelheid nodig. Een ander voordeel is dat het afweersysteem in het oog minder reactief is. De kans op een afweerreactie en ontsteking die het effect van de behandeling zou blokkeren, is daardoor beperkt.
De succesvolle behandeling van deze vorm van erfelijke blindheid heeft de weg geopend voor eenzelfde behandeling van andere erfelijke blindheidsvormen.
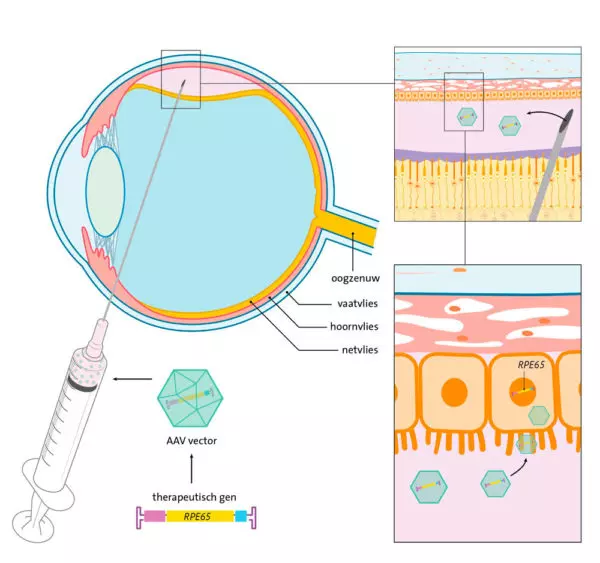
In vivo toediening van AAV-gentherapie. Een voorbeeld van in vivo gentherapie is de behandeling van gezichtsverlies veroorzaakt door mutatie in het RPE65-gen. Het RPE65-gen codeert voor een enzym dat het all-trans-retinylester omzet naar 11-cis-retinol, als onderdeel van de cyclus die plaatsvindt in de lichtgevoelige cellen van het netvlies. De werkzame stof in het geneesmiddel Luxturna is een AAV-vector die een functionele kopie van het RPE65-gen bevat. Na injectie in het oog, onder het netvlies, geeft de AAV-vector dit gen af in de cellen van het netvlies, de laag aan de achterkant van het oog die licht waarneemt. Hierdoor kan het netvlies de eiwitten maken die nodig zijn om te kunnen zien. Het functionele gen blijft in de celkern als een soort minichromosoom aanwezig; het integreert niet in het DNA van de cel. © Medical Visuals/ Maartje Kunen
Gentherapie voor de spierziekte spinale musculaire atrofie
Spinale musculaire atrofie (SMA) is de meest voorkomende genetische doodsoorzaak bij jonge kinderen. SMA type 1 wordt veroorzaakt door een tekort aan het eiwit Survival Motor Neuron 1 (SMN1). SMN1 is essentieel voor de motorische zenuwcellen die de spieren aansturen. Door SMN1-tekort sterven deze zenuwcellen af, wat leidt tot spierverlamming. Kinderen met deze ernstige vorm van SMA overlijden voor hun 2de levensjaar door verlamming van de ademhalingsspieren.
Bij SMN1-gentherapie wordt een hoge dosis van AAV9-SMN1 via een infuus in een ader geïnjecteerd. Om voldoende zenuwcellen te bereiken, is veel vector nodig. Dit herstelt mogelijk de SMN1-expressie in de zenuwcellen en voorkomt zo dat ze afsterven en de patiënten verlamd raken. Hoe goed de therapie werkt is nog niet geheel duidelijk. De resultaten op de wat langere termijn zijn nog niet beschikbaar in het publieke domein. Hoe het opgroeien van deze jonge kinderen verder verloopt, wordt intensief gevolgd door de fabrikant in samenwerking met behandelaren.
Een ander type behandeling voor SMA, nusinersen (Spinraza), wordt gebruikt bij alle typen SMA. Inmiddels worden sommige patiëntjes die gentherapie hebben ontvangen ook behandeld met nusinersen, een combinatietherapie dus. Hoe dit verloopt qua effectiviteit en veiligheid is niet bekend. Een derde oraal middel, risdiplam, is in ontwikkeling. Dit laat zien dat er voor sommige zeldzame ziekten opeens meerdere middelen met verschillende werkingsmechanismen ontwikkeld worden.
Lopend onderzoek voor andere ziekten
Nieuwe gentherapieën worden eerst uitgebreid getest in kleine groepen patiënten op veiligheid en werkzaamheid. Op dit moment doorlopen verschillende gentherapiebehandelingen de laatste fase van deze testen en de gerapporteerde resultaten zijn veelbelovend.
Op de Horizonscan Geneesmiddelen van het Zorginstituut, die twee jaar vooruitkijkt, staan behandelingen op stapel op basis van AAV voor de bloedingsziekte hemofilie A en B, en voor de oogziekte Leber Hereditaire Optische Neuropathie (LHON). Bij de oogziekte moet het functionele gen in een speciaal organel in de cel terecht komen, namelijk in het mitochondrium. Dit gebeurt door het toevoegen van een speciaal anker aan het gen dat ervoor zorgt dat het functionele eiwit in het mitochondrium terechtkomt.
Voor andere medische studies met gentherapieën op basis van AAV zijn de resultaten nog niet bekend en is de procedure voor markttoelating nog niet gestart. Een voorbeeld hiervan is gentherapie voor Duchenne spierdystrofie.
Lopend onderzoek voor Duchenne spierdystrofie
De Duchenne spierdystrofie wordt veroorzaakt door een fout in het dystrofine-gen. Deze spierziekte komt vrijwel alleen bij jongens voor. Dystrofine is belangrijk voor het goed functioneren van spiercellen en nodig voor de stevigheid van de spieren. Een tekort aan dystrofine, veroorzaakt door een fout in het gen, leidt tot het afsterven van deze spiercellen. De spieren worden zwakker en raken verlamd.
In verschillende studies wordt in patiënten getest of met gentherapie met AAV-vectoren het dystrofineniveau in de spieren hersteld kan worden om zo verdere achteruitgang te vertragen of te stoppen. Omdat het dystrofine-gen te groot is voor de AAV-vector, wordt een korter dystrofine-gen gebruikt. Dit beperkt de spierschade sterk, maar voorkomt het niet volledig. Om alle spieren te bereiken wordt de AAV-vector via de bloedbaan toegediend. Voor een effectieve behandeling van alle spieren is een hoge dosis nodig. Of dat mogelijk is zonder ernstige bijwerkingen, moet nog blijken.
Mis nooit meer een publicatie
Met een jaarabonnement mis je niets meer! Wil je altijd op de hoogte blijven van de nieuwste ontwikkelingen op het gebied van de biowetenschappen? Neem dan een abonnement! Hiermee ontvang je een korting van 40% ten opzichte van de prijs in de webwinkel. Daarnaast betaal je geen verzendkosten bij een abonnement. Het abonnement gaat in per 1 januari van het nieuwe kalenderjaar. Je kunt te allen tijde opzeggen, waarna je alleen nog de cahiers ontvangt die je hebt betaald.

Nooit meer iets missen?
Wil je altijd op de hoogte blijven van nieuwe publicaties, dossiers en lesmaterialen? Schrijf je dan in voor onze nieuwsbrief. Wij sturen je maandelijks een overzicht van alle nieuwe content.